Archívny článok
Autor: Peter Novák
Wiskottov-Aldrichov syndróm
Wiskottov-Aldrichov syndróm (WAS) je porucha spojená s chromozómom X vyznačujúca sa klinickými príznakmi ako mikrotrombocytopénia (redukcia v počte a vo veľkosti doštičiek), ekzém, opakujúce sa infekcie a abnormálna funkcia imunitného systému.
V roku 1937 Dr. Alfred Wiskott, nemecký pediater, prvýkrát opísal prípad troch bratov, ktorí mali opakujúce sa ušné infekcie, ekzém a chronickú krvavú hnačku. Všetci traja bratia zomreli do 2 rokov na krvácanie alebo infekciu. Neskôr v roku 1954 Dr. Robert Anderson Aldrich, rovnako pediater, informoval o holandských príbuzných chlapcoch, z ktorých všetci zomreli na podobné klinické príznaky, ktoré opísal Wiskott. V súčasnosti už vieme, že tieto prípady boli spojené mutáciou v chromozóme X. O štyridsať rokov neskôr bol gén zodpovedný za WAS identifikovaný na krátkom ramene chromozómu X (Xp11.22-p11.23) analýzou väzieb. Keďže ide o recesívne X-viazané ochorenie, klinicky sa ochorenie manifestuje u chlapcov.
WAS je spôsobený rôznymi mutáciami v géne kódujúcom tzv. WAS proteín (skrátene aj WASp). Táto mutácia je exprimovaná v hematopoetických bunkách (napr. v lymfocytoch) a zhoršuje normálnu funkciu WAS proteínu pri aktínovej polymerizácii. Absencia expresie WASp vedie ku klasickým prejavom Wiskottovho-Aldrichovho syndrómu. Následná expresia mutovaného proteínu WAS spôsobuje X-viazanú trombocytopéniu, ktorá patrí k hlavným príznakom WAS.
Proteín Wiskottovho-Aldrichovho syndrómu (WASp) je proteín zložený z 502 aminokyselín a je exprimovaný v cytoplazme neerytroidných hematopoetických buniek. Doposiaľ bolo identifikovaných viac ako 300 jedinečných mutácií v géne kódujúcom WASp. Najbežnejšie mutácie sú missense mutácie, po ktorých nasledujú nezmyselné zostrihové mutácie a krátke delečné mutácie.
Klinické príznaky
Vo svojej klasickej podobe sa WAS typicky vyznačuje tromi základnými klinickými črtami. V prvom rade ide o zvýšenú tendenciu ku krvácaniu, ktoré je spôsobené významne zníženým počtom krvných doštičiek, ďalej o opakujúce sa bakteriálne, vírusové a plesňové infekcie a ekzémy kože. Okrem tejto základnej triády symptómov majú pacienti s WAS tiež zvýšené riziko vzniku závažného autoimunitného ochorenia a existuje u nich zvýšený výskyt malignity (rakovina), najmä lymfómu alebo leukémie.
Zvýšená tendencia ku krvácaniu
Trombocytopénia (znížený počet krvných doštičiek) je častým znakom pacientov s WAS. Okrem toho, že sa znížil ich počet, samotné doštičky sú malé a nefunkčné, čo predstavuje menej ako polovičnú účinnosť oproti normálnym doštičkám. Výsledkom je, že pacienti s WAS môžu ľahko krvácať, dokonca aj vtedy, keď neboli zranení. Krvácanie do pokožky môže spôsobiť drobné modročervené škvrny, nazývané petéchie, alebo aj väčšie škvrny pripomínajúce modriny. Postihnutí chlapci môžu mať krvavé hnačky (najmä v detskom veku), krvácanie z ďasien a dlhodobé krvácanie z nosa. Jednou z nebezpečných komplikácií je hemorágia (krvácanie) do mozgu. Pretože WAS je jediná porucha, pri ktorej sa v krvnom obraze nachádzajú malé krvné doštičky, ich prítomnosť je užitočným diagnostickým testom choroby.
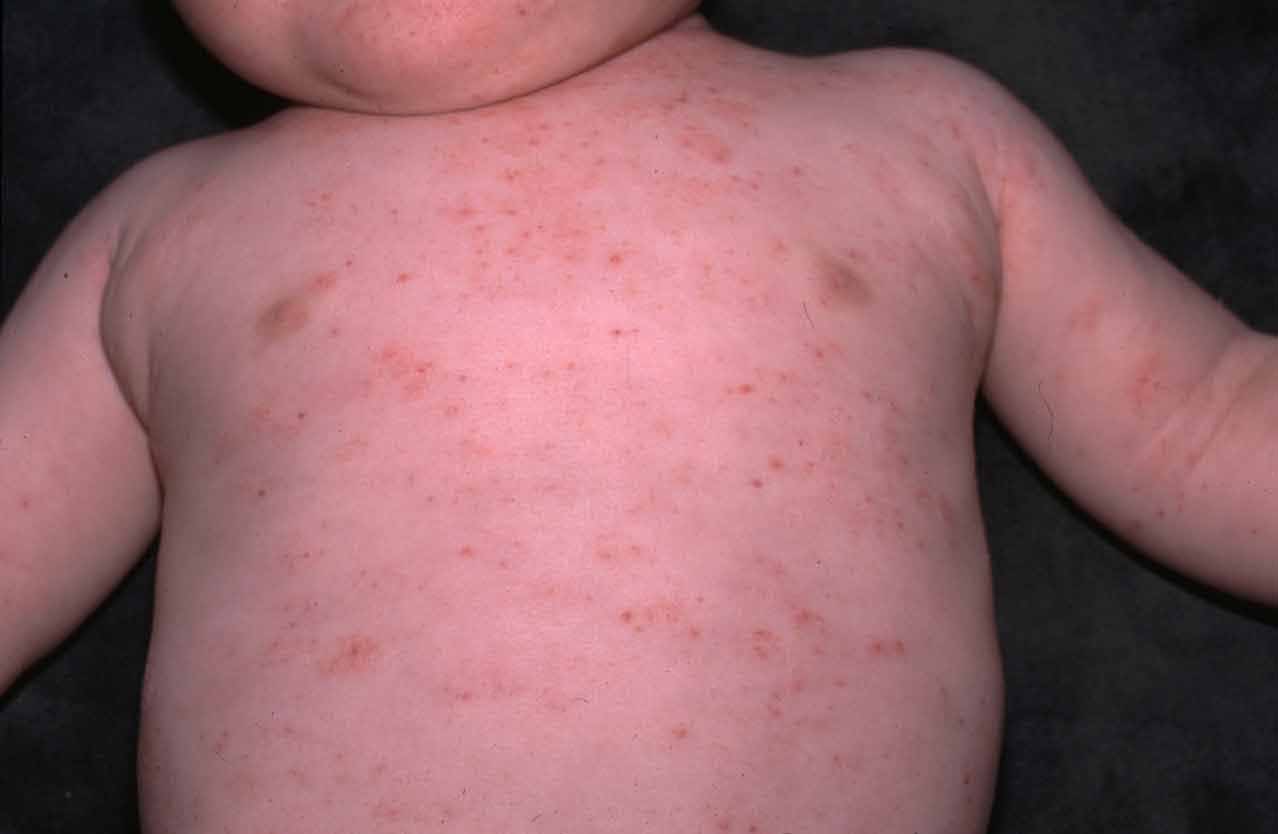
Jedným
z najbežnejších príznakov Wiskottovho-Aldrichovho syndrómu je výskyt
petéchií. (Zdroj: http://upload.medbullets.com/topic/105004/images/wiskott-aldrich-syndrome-picture.jpg)
Infekcie
Imunodeficiencia spojená s WAS spôsobuje, že funkcia B- aj T-lymfocytov je výrazne abnormálna. V dôsledku toho sú infekcie v klasickej forme WAS bežnejšie a môžu zahŕňať všetky triedy mikroorganizmov. Typickými sú infekcie horných a dolných dýchacích ciest, ako sú infekcie dutín a pneumónia, vyskytujú sa tiež ušné infekcie. Závažnejšie stavy, akými sú sepsa, meningitída a závažné vírusové ochorenia, sú menej časté, ale môžu sa vyskytnúť. U pacientov s klasickou formou WAS sa občas môže vyvinúť pneumónia spôsobená hubou Pneumocystis jirovecii. Koža môže byť infikovaná napríklad baktériami rodu Staphylococcus v oblastiach, kde si pacienti poškriabali ekzém. Okrem toho sa pri WAS bežne vyskytuje aj vírusová kožná infekcia nazývaná molluscum contagiosum. Vakcinácia na prevenciu infekcií pri WAS je často neúčinná, pretože pacientov imunitný systém nemá normálne reakcie ochranných protilátok na vakcíny.
Ekzém
Ekzémová vyrážka je častý príznak u pacientov s klasickým WAS. U dojčiat sa ekzém môže objaviť na tvári alebo na temene hlavy a môže sa podobať seboroickej dermatitíde. Môže sa tiež prejaviť závažnou vyrážkou v oblasti nosenia plienky alebo môže byť zovšeobecnený, postihujúc ruky a nohy. U starších chlapcov je ekzém často obmedzený na kožné vrásky v okolí lakťov alebo kolien, za ušami alebo okolo zápästia. Keďže ekzém je veľmi iritujúci, pacienti sa často škriabu, čím si spôsobujú krvácanie. Oblasti, v ktorých je kožná bariéra porušená, potom môžu slúžiť ako vstupné body pre baktérie spôsobujúce infekcie kože a krvi.
Autoimunitné prejavy
Pojem autoimunita označuje situáciu, v ktorej sa vlastný imunitný systém obracia proti špecifickým bunkám alebo orgánom tela a útočí na ne. Klinické problémy spojené s autoimunitou sú pri WAS bežné a postihujú takmer polovicu všetkých pacientov. Medzi najbežnejšie pozorované autoimunitné prejavy patrí deštrukcia červených krviniek alebo krvných doštičiek autoreaktívnymi protilátkami generovanými imunitným systémom. Deštrukcia červených krviniek sa nazýva hemolytická anémia a deštrukcia doštičiek sa nazýva idiopatická trombocytopenická purpura (ITP). ITP môže znížiť už aj tak nízky počet krvných doštičiek. Ďalším častým autoimunitným ochorením pri WAS je typ zápalu krvných ciev, ktorý zvyčajne spôsobuje horúčku a kožnú vyrážku na končatinách. Vaskulitída môže ovplyvniť svaly, srdce, mozog alebo iné vnútorné orgány, čo spôsobuje celý rad ďalších symptómov.
Malignita
Pacienti s WAS majú zvýšené riziko malignít (rakoviny) v porovnaní s normálnymi jedincami. Celkovo sa odhaduje, že u 15 – 20 % pacientov sa nakoniec malignity vyvinú. Lymfómy alebo leukémie sú najbežnejšie typy rakoviny, pričom non-Hodgkinov lymfóm tvorí väčšinu prípadov. Malignity sa môžu vyskytnúť aj u malých detí, sú však bežnejšie medzi staršími pacientmi.
Miernejšie formy choroby
Klinická prezentácia WAS sa líši od pacienta k pacientovi. Niektorí pacienti majú všetky klasické prejavy zo spomínanej triády, zatiaľ čo iní vykazujú len nízky počet krvných doštičiek a prítomnosť krvácania. Spočiatku bola táto miernejšia manifestácia nazývaná trombocytopénia spojená s chromozómom X (XLT). Až po objavení génu, ktorý spôsobuje WAS, sa ukázalo, že obe poruchy sú spôsobené mutáciami v rovnakom géne. Pacienti s XLT obvykle nemajú významnú imunodeficienciu, ale majú zvýšené riziko malignity, hoci riziko nie je také vysoké ako pri WAS. Ďalšia veľmi zriedkavá porucha spojená s mutáciou v géne WAS spôsobuje formu neutropénie (znížený počet neutrofilov) nazývanú XLN.
Diagnostika
Diagnostika Wiskottovho-Aldrichovho syndrómu by sa mala zvážiť u každého chlapca, ktorý má nezvyčajné krvácanie a modriny, vrodenú alebo skorú trombocytopéniu a malé krvné doštičky. Charakteristické abnormality krvných doštičiek vrátane malého počtu a malej veľkosti krvných doštičiek sú takmer vždy prítomné, dokonca aj v pupočníkovej krvi novorodencov. Najjednoduchším a najrýchlejším testom na zistenie, či pacient môže mať WAS, je získať počet krvných doštičiek a starostlivo určiť ich veľkosť.
Imunitné problémy sa zvyčajne začínajú prejavovať u batoliat a starších detí, keď u pacientov začína narastať počet infekcií. Vyhodnotenie funkcie imunitného systému zvyčajne ukazuje, že pacienti nie sú schopní dobrých protilátkových reakcií na určité typy vakcín, najmä na tie, ktoré obsahujú polysacharidy alebo iné komplexné cukry, ako je vakcína proti pneumokokovým ochoreniam (Pneumovax). Hladiny IgE sú obvykle zvýšené a funkcia T-lymfocytov je často abnormálna.
Definitívnu diagnózu WAS možno stanoviť sekvenovaním génu WAS na identifikáciu mutácie a štúdiom krvných buniek pacienta, aby sa zistilo, či je proteín WASp exprimovaný v normálnych hladinách. Tieto testy sa vykonávajú v niekoľkých špecializovaných laboratóriách a vyžadujú krv alebo iné tkanivo.
Liečba
Pacienti potrebujú ostražitú všeobecnú lekársku alebo detskú starostlivosť. Vyžaduje sa okamžitá a účinná liečba infekcie a krvácania. Všeobecné liečebné stratégie zahŕňajú použitie antibiotík, intravenóznej imunoglobulínovej terapie (IVIG), splenektómie (v osobitných prípadoch), génovej terapie a skorej transplantácie krvotvorných kmeňových buniek (HSCT). Imunomodulačné činidlá, napr. rituximab, môžu zohrávať úlohu pri pridruženej autoimunite.
WAS sa lieči rôznymi terapeutickými prostriedkami z viacerých kategórií vrátane antibiotík, antivirotík, antimykotík, chemoterapeutických látok, imunoglobulínov a kortikosteroidov. Látky sa vyberajú na základe klinickej prezentácie a odpovede pacienta. Pri liečbe infekcií, ak je to možné, sa identifikuje podozrivý patogén pred výberom antibiotík, antivírusových alebo antimykotických liekov. Antibiotiká sú indikované na liečbu bakteriálnych infekcií a na profylaxiu u pacientov, ktorí mali splenektómiu. Antivírusové a protiplesňové látky sa podávajú pri liečbe vírusových a plesňových infekcií. Chemoterapeutické látky sú indikované na liečenie lymforetikulárnych alebo hematologických malignít, ale tiež sa používajú ako ablatívne činidlá s ožarovaním celého tela alebo bez neho pred transplantáciou kostnej drene. Imunoglobulíny a systémové kortikosteroidy sú indikované na liečbu trombocytopénie. Na liečbu ekzému sa používajú lokálne steroidy.
Génová terapia
Génová terapia WAS je terapia, pri ktorej sa normálna kópia génu WAS dodáva do buniek pacientovej kostnej drene pomocou vírusu, takže krvné bunky pochádzajúce z kostnej drene sú potom schopné vyrobiť normálny proteín WASp. Pretože sa modifikujú vlastné bunky pacienta, nehrozí riziko odmietnutia transplantátu hostiteľom, ktoré môže nastať po transplantácii kostnej drene. Hlavné riziko génovej terapie spočíva v tom, že vírus môže vložiť kópiu svojej DNA do jedného z chromozómov pacienta spôsobom, ktorý zapríčiní abnormálnu produkciu jedného alebo viacerých proteínov spôsobujúcich rakovinu. V súčasnosti prebiehajú štúdie na testovanie nových vírusov génovej terapie, ktoré sú potenciálne bezpečnejšie, a na vývoj alternatívnych metód nevírusovej génovej terapie. Génová terapia sa zatiaľ použila na úspešnú liečbu malého počtu pacientov s WAS, na nápravu ich problémov s krvácaním a imunitného deficitu. Počiatočný úspech génovej terapie vo WAS je veľmi povzbudivý, no pred jeho rozsiahlejším uplatnením v praxi je ešte potrebné vyriešiť spomínané problémy.
Pred tridsiatimi rokmi bola WAS považovaná za fatálnu poruchu s predpokladanou dĺžkou života iba dva až tri roky. Aj keď WAS stále zostáva vážnym ochorením s potenciálne život ohrozujúcimi krvácavými a infekčnými komplikáciami, vylepšenia v suplementácii imunoglobulínu, antibiotík a iná podporná starostlivosť zvýšili pacientom kvalitu života a významne predĺžili ich životy. Nedávny úspech génovej terapie WAS naznačuje, že ak sa podarí zabrániť vážnym vedľajším účinkom pozorovaným u niektorých pacientov, v budúcnosti sa zaradí medzi najúčinnejšie metódy liečby pacientov s WAS.
Článok vyšiel v časopise Farmakoviny, číslo 1, akademický rok 2020/2021. Celé číslo nájdete na odkaze: https://issuu.com/farmakoviny/docs/farmakoviny_okt_ber_2020
Zdroje:
Candotti F. Clinical Manifestations and Pathophysiological Mechanisms of the Wiskott-Aldrich Syndrome. J Clin Immunol. 2018 Jan. 38 (1):13-27.
Sullivan KE, Mullen CA, Blaese RM, Winkelstein JA. A multiinstitutional survey of the Wiskott-Aldrich syndrome. J Pediatr. 1994 Dec. 125(6 Pt 1):876-85.
Snapper SB, Rosen FS. The Wiskott-Aldrich syndrome protein (WASP): roles in signaling and cytoskeletal organization. Annu Rev Immunol. 1999. 17:905-29.
Kwan SP, Hagemann TL, Radtke BE, et al. Identification of mutations in the Wiskott-Aldrich syndrome gene and characterization of a polymorphic dinucleotide repeat at DXS6940, adjacent to the disease gene. Proc Natl Acad Sci U S A. 1995 May 9. 92(10):4706-10.
Yin HL, Stull JT. Proteins that regulate dynamic actin remodeling in response to membrane signaling minireview series. J Biol Chem. 1999 Nov 12. 274(46):32529-30.
Snapper SB, Meelu P, Nguyen D, et al. WASP deficiency leads to global defects of directed leukocyte migration in vitro and in vivo. J Leukoc Biol. 2005 Mar 17.
Westerberg L, Larsson M, Hardy SJ, et al. Wiskott-Aldrich syndrome protein deficiency leads to reduced B-cell adhesion, migration, and homing, and a delayed humoral immune response. Blood. 2005 Feb 1. 105(3):1144-52.
Zhang H, Schaff UY, Green CE, Chen H, Sarantos MR, Hu Y. Impaired integrin-dependent function in Wiskott-Aldrich syndrome protein-deficient murine and human neutrophils. Immunity. 2006 Aug. 25(2):285-95.
Remold-O'Donnell E, Rosen FS. Sialophorin (CD43) and the Wiskott-Aldrich syndrome. Immunodefic Rev. 1990. 2(2):151-74.
Huang W, Ochs HD, Dupont B, et al. The Wiskott-Aldrich syndrome protein regulates nuclear translocation of NFAT2 and NF-kappaB (RelA) independently of its role in filamentous actin polymerization and actin cytoskeletal rearrangement. J Immunol. 2005 Mar 1. 174(5):2602-11.
Ochs HD, Notarangelo LD. Structure and function of the Wiskott-Aldrich syndrome protein. Curr Opin Hematol. 2005 Jul. 12(4):284-91.
Notarangelo LD, Notarangelo LD, Ochs HD. WASP and the phenotypic range associated with deficiency. Curr Opin Allergy Clin Immunol. 2005 Dec. 5(6):485-90.
Ochs HD, Thrasher AJ. The Wiskott-Aldrich syndrome. J Allergy Clin Immunol. 2006 Apr. 117(4):725-38; quiz 739.
https://emedicine.medscape.com/article/137015-overview
http://www.pathologyoutlines.com/topic/spleenwiskott.html
https://www.ncbi.nlm.nih.gov/books/NBK539838/
https://ghr.nlm.nih.gov/condition/wiskott-aldrich-syndrome#
https://www.sciencedirect.com/topics/neuroscience/wiskott-aldrich-syndrome-protein
.
